体外诊断试剂价格(体外诊断试剂有哪些产品)
医院等级,所处地区不同价格有区别,项目是最关键的因素看你提供的例数应该是三类产品,以北京地区的肿瘤医院 CA125为例,一例可能需要60元,仅供参考。
在世界经合组织国家中,最大的体外诊断试剂市场为北美地区,2010年北美市场销售额为1845亿美元,到2012年增长到221亿美元而西欧市场2010年为137亿美元,到2012年达到150亿美元在欧洲,最大的单一市场是德国,2012年IVD。
确需单设临时项目满足公立医疗机构新冠病毒检测收费需求的,鼓励各地按“技耗分离”的方式立项核酸抗体检测的样本采集处理标记回收出具诊断结果,以及鼻咽拭子等消耗品应合并作为医疗服务价格项目定价体外诊断试剂盒。
申购代码,申购价格419元,单一账户申购上限39万股,公司主营体外诊断试剂的研发生产和销售合富中国本次募集资金扣除发行费用后,将用于医疗检验集约化营销及放肿高新仪器引进项目信息化升级和医管交流中心项目。
体外诊断试剂分两类一类是按照医疗器械来管理的,包括可单独使用或与仪器器具设备或系统组合使用,在疾病的预防诊断治疗监测预后观察健康状态评价以及遗传性疾病的预测过程中,用于对人体样本各种体液细胞。
其中,属于自行采购,允许在医疗服务价格项目外收费的“体外诊断试剂盒”,医保最高结算标准为新冠试剂跨省联盟集中采购中选试剂的中选价格以后随中选价格调整而调整,并实行医保限额报销属于政府调拨或社会捐赠,不得向。
因此国家法定用于血源筛查的试剂盒就是以上除了丙氨酸氨基转移酶以外的五种血液病毒抗原抗体的筛查试剂盒2放射性核素标记的体外诊断试剂 至于放射性核素标记的体外诊断试剂,CFDA批准最多的便是放射免疫药盒放射免疫法是利用。
请问你是要注册一般的体外诊断试剂公司还是发你双证的体外诊断试剂经营公司,双证是指体外诊断试剂经营许可证医疗器械证和药品经营许可证因为这个体外诊断试剂里包含一大部分是医疗器械管理内容,一小部分是属于药品管理的目前。
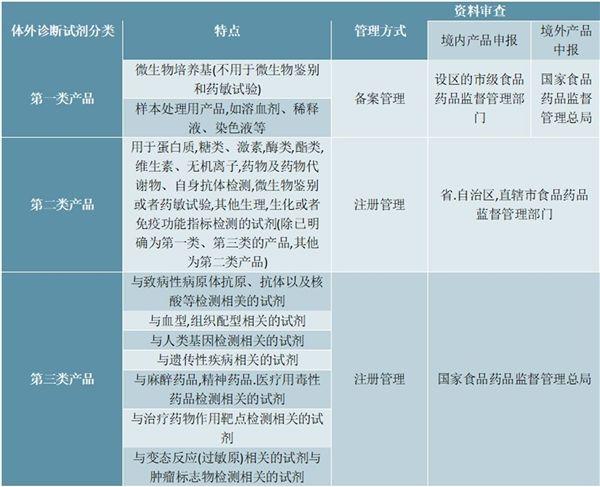
体外诊断试剂注册管理办法称体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测预防诊断治疗监测预后观察和健康状态的评价的过程中,用于人体样本体外检测的试剂试剂盒校准品质控品等产品可。
17艾德生物一家肿瘤精准医疗分子诊断的领军企业 拓展知识一体外诊断试剂简介 体外诊断试剂注册管理办法试行所称体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器器具设备或系统组合。
根据产品风险程度的高低,体外诊断试剂依次分为第三类第二类第一类产品第三类产品1与致病性病原体抗原抗体以及核酸等检测相关的试剂2与血型组织配型相关的试剂3与人类基因检测相关的试剂4与遗传性。
体外诊断试剂注册管理办法试行所称体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器器具设备或系统组合使用,在疾病的预防诊断治疗监测预后观察健康状态评价以及遗传性疾病的预测过程中。
体外诊断试剂注册管理办法国家食品药品监督管理总局令第5号第三条本办法所称体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测预防诊断治疗监测预后观察和健康状态评价的过程中,用于人体。
首先,应当起草临床试验方案,在2018年11月22日,药监局发布的体外诊断试剂临床试验指导原则征求意见稿中对临床试验方案的内容基本格式试验方法样本量等作了详细要求其中应当包含一般信息临床试验的背景资料。
体外诊断属于高新技术行业,行业的核心在于诊断检测的技术平台和反应体系,企业核心的竞争力主要在于其技术水平按检测方法或原理划分,我国体外诊断试剂包括 生化诊断免疫诊断分子诊断POCT即时诊断凝血类诊断和血液学。
5精密度是考察体外诊断试剂对同一样本重复测定时能否得到相同实验结果的能力的指标,也就是说对同一样本再次进行测定的结果是否与第一次相同的程度精密度评价是质量控制的重要内容,也是是评价拟上市产品有效性的重要依据。
稳定性是体外诊断试剂随时间推移保持特性一致性的能力,是试剂必须具有的基本属性,是确保试剂使用过程中有效性的重要指标,也是生产商的职责 一国内体外诊断试剂稳定性研究现状 1企业将研究重点放在效期稳定性和加速稳定性研究上,忽视了。
标签: 体外诊断试剂价格
相关文章



发表评论